タンパク質とタンパク質や核酸等との相互作用

「Biomolecular NMR」カタログ(大陽日酸 2015) 寄稿文

西村善文
横浜市立大学
学長補佐
ヒトゲノムの解析により、ヒトは約23,000個の遺伝子を持っている事が分かった。これらの遺伝子は多くの場合、タンパク質に翻訳されて機能する。生じたタンパク質は様々な生体分子と相互作用して、その機能を発揮する。よって遺伝子の働きを知るためには、遺伝子産物であるタンパク質の働きを知る必要がある。タンパク質は他のタンパク質やDNA、RNA等の核酸や、様々な代謝化合物と相互作用して働く。その結合の詳細を知るために、タンパク質を構成している分子の原子レベルでの理解が必須となりつつある。
タンパク質の働きは様々な生命機能の維持に必要なので、その働きが異常になると様々な病気になる。このような様々な病気に関わるタンパク質の働きを制御できれば、病気の治療も可能になる。病気の原因となるタンパク質は、様々な理由で機能が異常になっているが、機能異常を制御できる化合物が薬となる。タンパク質の相互作用を精密に制御するためには、タンパク質による相互作用の詳細を知る必要があり、タンパク質を構成する分子中の原子レベルでの相互作用を解明する必要がある。このような合理的な考えかたで薬を創造していくためには、原子レベルでタンパク質の相互作用の実態を解明する必要がある。その中の手法の一つとして近年注目を浴びているのが、核磁気共鳴(Nuclear Magnetic Resonance:NMR)である。
NMRは、原子核のスピンの状態を検査する手法である。原子核のスピンは、陽子の数が同じ原子でも、構成している中性子の数によって変化し、質量が異なる同位体が存在する。タンパク質中の原子として非常に多いものには、水素原子、炭素原子、窒素原子がある。これらの原子核で、通常は質量が1の水素原子(1H)のみがNMRで活性である。炭素原子(C)は、通常は質量が12(12C)で全くNMR活性ではないが、安定同位体の質量が13の炭素原子13Cは、水素原子と同じ核スピンを持ち、NMR活性になる。また、窒素原子も通常は質量が14でNMR活性は弱いが、質量が15の窒素原子15Nは水素原子と同じ核スピンを持ちNMR活性が強くなる。
NMRの測定のためには、タンパク質中の炭素原子の質量を13に、窒素原子の質量を15にする必要がある。タンパク質をこれら安定同位体でラベルするためには、通常、大腸菌を用いた組換えタンパク質として発現し、精製してNMRの測定に用いる。大腸菌は、リン酸と窒素化合物と糖があれば生育できる。窒素化合物として安定同位体ラベルした15NH4Clと、糖として安定同位体でラベルした13C-グルコースをリン酸緩衝液中に溶解し、大腸菌を培養すると、大腸菌内のタンパク質の全ての 炭素は13Cでラベルされ、窒素は15Nでラベルされる。その様にして調製したタンパク質を用いて、NMRによる構造解析を当研究室では行っている。
また、分子量が大きなタンパク質では、15Nや13Cの測定に影響を及ぼす水素原子1Hを質量2の重水素2H(D)に置き換えるために、大腸菌を重水(D2O)中で培養する事もある。その様にして調製したタンパク質を通常の水(H2O)に溶かすと、炭素原子などに結合した水素原子はDのままだが、アミドのように窒素原子に結合したDは溶媒中のHと交換し、1H-15Nの相関を測定できる。また、更に大きなタンパク質では1Hと15Nと13Cの全てを観測するのではなく、タンパク質中のメチル基のみを13C-1H3に置換し、他の原子を14Nと12C 、Dにして観測するMe-TROSY法もよく使用される。その場合には、重水素化グルコースとメチル基をラベルした酪酸を培養に用いる。
また、タンパク質発現に必要な細胞の破砕液を用意し、細胞中ではなくセルフリーの系にタンパク質発現のための遺伝子DNAを加えて、安定同位体ラベルタンパク質を得る事も行われている。この場合、安定同位体でラベルしたアミノ酸を加える必要があるが、15Nでラベルされたアミノ酸、15Nと13Cでラベルされたアミノ酸、15Nと13CとDでラベルされたアミノ酸、更にはメチレンやメチル基の水素原子の1個のみを立体特異的に1Hとし、15Nと13CとDでラベルされたアミノ酸(SAIL アミノ酸)など、様々な安定同位体ラベルアミノ酸が市販されている。また、細胞破砕液としては、大腸菌由来と小麦胚芽由来のものなどがあり、どちらも市販されている。
タンパク質の構造解析として、X線結晶構造解析がよく用いられる。結晶ができれば、巨大なタンパク質複合体でも構造が解析できるので、様々なタンパク質やその複合体構造が解析され、報告されている。その様な状況で、NMRによるタンパク質の構造解析の利点があるとしたら、結晶化できないタンパク質の構造解析である。特に最近、真核生物の核内に存在するタンパク質の半分以上は、単独では特定の構造をとっていない天然変性タンパク質である事が知られるようになってきた。これら核内タンパク質は、遺伝子の総体であるゲノムが同じでも、表現形が異なるエピゲノムと呼ばれるゲノムを超えた現象に関係している。遺伝子DNAが全く同じでも、DNAが核内でとるクロマチン構造が異なると、遺伝子の発現は異なる。
遺伝子の発現は多くの場合、転写レベルで調節されているので、クロマチン構造や転写に関連するタンパク質が、エピゲノムの中心になっている。エピゲノムが重要視されるのは、同じ遺伝子を持っている生体の細胞に4種類の転写因子を発現させると、初期化細胞であるiPS細胞が誘導される事である。また、神経疾患やがん等の様々な病気でエピゲノムの変化が重要である事が分かってきた。これらエピゲノム関連タンパク質は、ほとんどの場合、天然変性領域を持っている。p53はゲノムの守護神と呼ばれ、様々な生物学的過程に関与する非常に重要なタンパク質で、がん抑制タンパク質として知られ、悪性腫瘍の半分以上でp53遺伝子の異常が見つかっている。p53の働きを正常化できると、多くのがんは治癒できる可能性がある。
p53は、N末約70アミノ酸領域の転写活性化ドメインと中央部約200 アミノ酸領域のDNA結合ドメインとC末の4量体形成ドメインを持つ約400 アミノ酸からなるタンパク質である。各々のドメインの複合体の構造解析は、そのタンパク質の重要性から長年にわたって多くの研究者により解析されてきた。N末の転写活性化ドメインは、9個のリン酸化されるセリン残基やトレオニン残基を持っている。各々のリン酸化が標的タンパク質との相互作用を制御しているので、p53の転写活性化ドメインの特定の部位のリン酸化が構造に及ぼす影響を研究する事は非常に重要である。約70アミノ酸からなるp53の転写活性化ドメインは、単独では特定の構造をとらない天然変性タンパク質であるので、標的タンパク質とどのように相互作用するかが注目されてきた。
これまでにもp53の転写活性化ドメインと7種類以上の標的タンパク質の複合体構造が解析されてきたが、解析されたその全てのp53の転写活性化ドメインは非リン酸化体であった。非リン酸化体のp53の転写活性化ドメインは、標的タンパク質の表面で両新媒性ヘリックスを形成していたので、結合に伴うヘリックス形成が重要な認識機構である事が示唆された。しかし、最近、当研究室の特任助教の奥田博士が、46番のセリンと56番のトレオニンがリン酸化されたp53の転写活性化ドメインと基本転写因子のT F I I H のp62 サブユニットのPHドメインとの複合体構造をNMRで解析したところ、リン酸化したp53の転写活性化ドメインが、標的タンパク質の表面で伸びた紐状構造で結合している事を初めて解明した。この解明には、先ほど述べた安定同位体でラベルしたタンパク質を使用している。
リン酸化された天然変性タンパク質が伸びた紐状構造で結合する様子を、初めて明らかにする事ができた。伸びた紐状の転写活性化ドメインは、リン酸化セリンとリン酸化トレオニンとアスパラギン酸やグルタミン酸を含んだ酸性ドメインなので、負に荷電した紐である。その紐がPHドメインの正に荷電した溝に埋まっている。さらに、この静電的な相互作用だけではなく、p53の転写活性化ドメイン中のトリプトファンの芳香環がPHドメインの疎水的な窪みに収まって、紐の位置を確定していた。この結合の様子は、既に我々が解析していたTFIIHと基本転写因子TFIIEとの相互作用と似ていた。遺伝子の発現の時にはTFIIHがTFIIEに結合してRNA合成酵素が活性化し、mRNAが合成される。遺伝子DNAが傷付くと、遺伝子の発現の転写を止めて遺伝子を修復する。
その時には、損傷したDNAに応じてp53がリン酸化され、TFIIHのPHドメインに強く結合できるようになり、TFIIHとTFIIEの相互作用を妨げ、TFIIHをDNA損傷部位にp53がリクルートする。その時のp53の認識機構を我々は解明した(図1)。
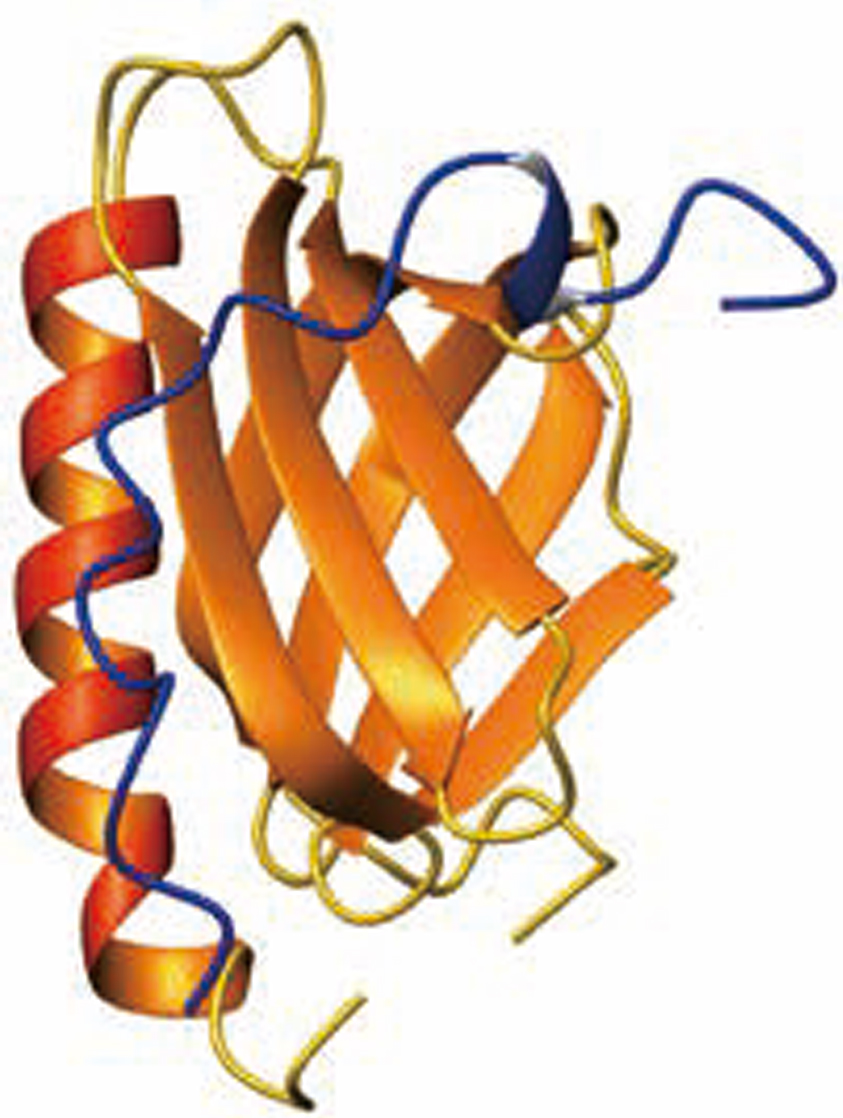
図1 青で表示したp 53のリン酸化転写活性化ドメインと標的タンパク質の複合体構造(Okuda, M. and Nishimura, Y., Extended String Binding Mode of the Phosphorylated Transactivation Domain of Tumor Suppressor p53. J. Am. Chem. Soc., 136, 14143-14152 (2014).)
また、安定同位体を利用したNMR構造解析の利点と して、もう一つ例を挙げる。遺伝子DNAは、細胞の核内でコンパクトに折りたたまれた染色体(クロマチン)構造をとっている。細胞毎にDNAの情報の発現は制御され、遺伝情報が発現しているところのクロマチンは緩んでいて、発現していないところでは非常に高度に凝集したヘテロクロマチンを形成する。ヘテロクロマチンの形成に関与するChp1タンパク質中のクロモドメインとヘテロクロマチンのヒストンとの複合体構造を、我々はNMRで解析した。その構造は、それまでX線を用いた結晶構造の結果とは異なり、図2の上部に長い紐状構造とそれに続く短いらせんが認められた。
ヘテロクロマチンの形成には非コードRNAが関与する事が分かっているが、NMRで新たに解析できた紐状構造と短いらせん構造部位がRNA結合に必要である事を明らかにした。これは結晶構造では分からない事であった。
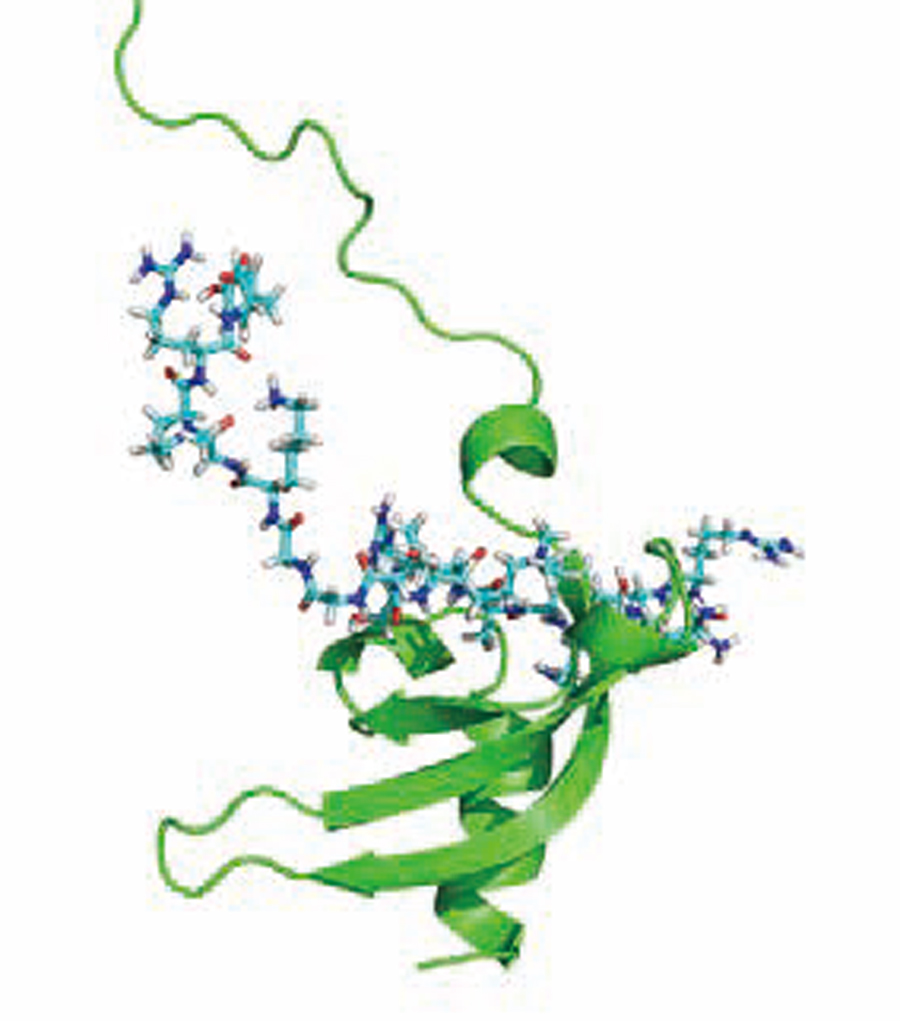
図2 水色で表示したヘテロクロマチンのヒストンに結合したChp1のクロモドメインを緑色で表示した. 上部に伸びている短いらせんとそれに続くひも状構造は結晶構造では解析されていないが, その領域で非コードRNAと相互作用しする事を見出した(. Ishida M, Shimojo H, Hayashi A, Kawaguchi R, Ohtani Y, Uegaki K, Nishimura Y, Nakayama J. Intrinsic nucleic acid-binding activity of Chp1 chromodomain is required for heterochromatic gene silencing. Mol. Cell, 47, 228-241 (2012).)


イノベーションユニット
SI事業部
045-872-1823
※月~金曜日
9:00~17:40
045-872-1825
Isotope.TNS@tn-sanso.co.jp
〒220-8561
神奈川県
横浜市西区
みなとみらい4-6-2
みなとみらい
グランドセントラルタワー 7F
大陽日酸㈱
みなとみらい事業所内

高圧ガス販売事業(第1種、第2種)
毒物劇物一般販売業 / 毒物劇物輸入業
医療をはじめ、研究から産業まで広くご利用いただける安定同位体試薬をご提供いたします。
Copyright © 2021. TAIYO NIPPON SANSO Corporation. All Rights Reserved.








