膜タンパク質機能解明における安定同位体の利用

「Biomolecular NMR」カタログ(大陽日酸 2015) 寄稿文

嶋田一夫
東京大学
教授

幸福裕
東京大学
助教
転移交差飽和法を用いたケモカインMIP-1α とその受容体CCR5との相互作用解析
Gタンパク質共役型受容体(GPCR)の一種であるケモカイン受容体CCR5と、そのリガンドMIP-1α は、様々な免疫応答やHIV感染に関与しており、その相互作用様式の解明が望まれている。一方で、CCR5の収量や安定性が低いために、十分な測定感度にて、NMRによる相互作用解析をおこなうことは困難であった。そこで、CCR5の安定化のために、界面活性剤の代わりに、より生理的条件に近い再構成高密度リポタンパク質(rHDL)の中にCCR5を埋め込みNMR試料とした(図1)。
さらにNMR測定の高感度化のために、大腸菌発現系により、MIP-1α のイソロイシン・ロイシン・バリン残基メチル基を選択的に13C標識し、それ以外を2Hグルコース、重水を用いて高度に2H標識した。これらの試料を用いて、我々が開発した転移交差飽和(TCS)法1)により相互作用解析を行った(図2)。その結果、MIP-1α 上のV59・V63を含む領域がCCR5と近接することを新たに同定した(図3)。この結果により、MIP-1α E57の変異がHIV感染に影響する機構として、変異がCCR5との相互作用に直接影響を与えることが示された2)。
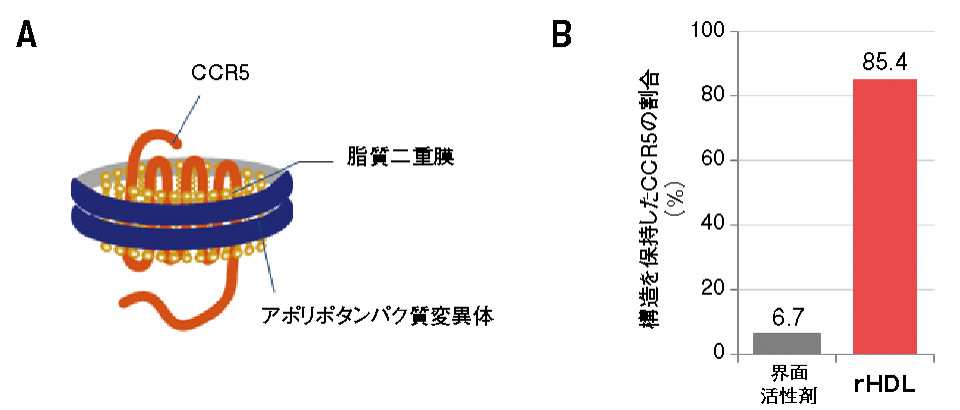
図1 CCR5のrHDLへの再構成(. A)rHDL中のCCR5の模式図(. B)界面活性剤中およびrHDL中で4 ℃にて24時間静置後に構造を保持しているCCR5の割合.
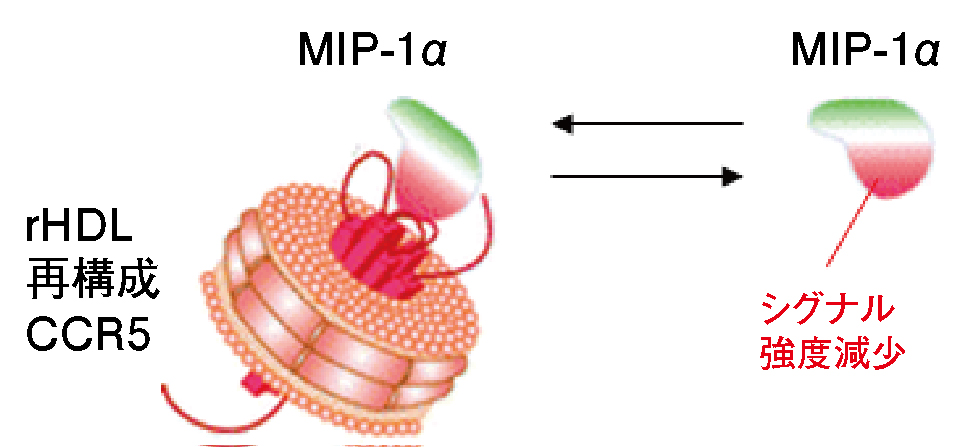
図2 TCS法の模式図. CCR5を選択的に飽和すると, その飽和は空間的に近接したMIP-1α にも伝播する. MIP-1α が結合状態と遊離状態を交換している場合には, 遊離状態のMIP-1α のCCR5相互作用界面に対応する残基のNMR シグナル強度が選択的に減少する.
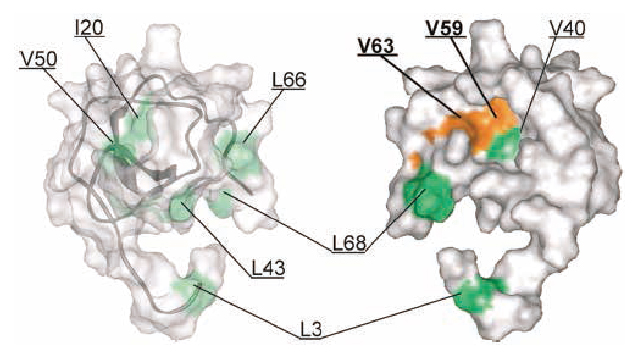
図3 TCS法による解析結果. TCSの結果, 強度減少した残基をMIP-1α の構造上に橙で, それ以外の残基を緑で示す. V59・V63を含む領域がCCR5に近接することが明らかとなった.
β2アドレナリン受容体の動的構造の解析によるシグナル伝達機構の解明
GPCRの一種であるβ2アドレナリン受容体(β2AR)は、気管支拡張などの生理応答に関与するが、β2ARを介したシグナル伝達強度が決まる機構は不明である。高分子量膜タンパク質であるβ2ARの高感度NMR解析には、メチル基の選択的13C標識や、その周囲の2H標識が必須である。一方で、活性を保持した β2ARの大量発現に必要な昆虫細胞発現系では、大腸菌や酵母で一般的な重水やアミノ酸前駆体を用いた標識法が適用できない。
そこで、我々は、昆虫細胞発現系において、標識アミノ酸を適切な量とタイミングで添加することにより、メチオニン残基メチル基を選択的に13C標識し、その周囲を2H標識する方法を新たに開発し、約5倍の感度向上を得た(図4)。これにより、rHDLの脂質二重膜中におけるβ2ARのNMRシグナルを、高感度に観測することに初めて成功した。様々なリガンドが結合した β2ARのNMRシグナルの解析から、β2ARが2種類の不活性化構造と1種類の活性化構造の間の動的構造平衡にあること、平衡における活性化構造の割合により β2ARのシグナル伝達強度が決定されていることが明らかになった(図5)3,4)。

図4 2H標識による β2ARのNMRシグナルの感度向上(. A)メチオニンメチル基を13C標識したrHDL再構成 β2ARの1H-13C相関スペクトル(. B)メチオニンメチル基を13C 標識し, さらにその周囲を2H標識したrHDL再構成 β2ARの1H-13C相関スペクトル. 点線部分の切り出しを各スペクトル上部に示す.
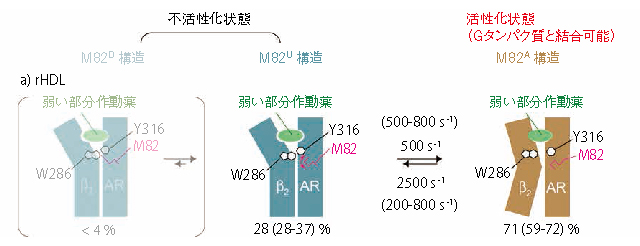
図5 安定同位体標識 β2ARのN M R解析から明らかになった動的構造平衡. 弱い部分作動薬が結合した状態における,各構造の割合とその間の交換速度を示す.
参考文献
1)Ueda, T., Takeuchi, K., Nishida, N., Stampoulis, P., Kofuku, Y., Osawa, M., & Shimada, I. Cross-saturation and transferred cross-saturation experiments. Q. Rev. Biophys., (2014), 47, 143-187.
2)Yoshiura, C., Kofuku, Y., Ueda, T., Mase, Y., Yokogawa, M., Osawa, M., Terashima, Y., Matsushima, K., & Shimada, I. NMR analyses of the interaction between CCR5 and its ligand using functional reconstitution of CCR5 in lipid bilayers. J. Am. Chem. Soc., (2010), 132, 6768-6777.
3)Kofuku, Y., Ueda, T., Okude, J., Shiraishi, Y., Kondo, K., Maeda, M., Tsujishita, H., & Shimada, I. Efficacy of the β2 - adrenergic receptor is determined by conformational equilibrium in the transmembrane region. Nature Communications, (2012), 3, 1045.
4)Kofuku, Y., Ueda, T., Okude, J., Shiraishi, Y., Kondo, K., Mizumura, T., Suzuki, S., & Shimada, I. Functional dynamics of deuterated β2 -adrenergic receptor in lipid bilayers revealed by NMR spectroscopy. Angew. Chem. Int. Ed., (2014), 53, 13376-13379.


イノベーションユニット
SI事業部
045-872-1823
※月~金曜日
9:00~17:40
045-872-1825
Isotope.TNS@tn-sanso.co.jp
〒220-8561
神奈川県
横浜市西区
みなとみらい4-6-2
みなとみらい
グランドセントラルタワー 7F
大陽日酸㈱
みなとみらい事業所内

高圧ガス販売事業(第1種、第2種)
毒物劇物一般販売業 / 毒物劇物輸入業
医療をはじめ、研究から産業まで広くご利用いただける安定同位体試薬をご提供いたします。
Copyright © 2021. TAIYO NIPPON SANSO Corporation. All Rights Reserved.








